
2.2.7 离去基团的效应
在大多数芳香亲电取代反应里,离去基团是H+,关于其它离去基团的相对的electrofugal能力,所做工作不是很多。可是,认为离去基团的能力是下面的顺序:(1)对离去不用协助的离去基团(相对于离去基团的SN1过程):
NO2+<i-Pr+~SO3<t-Bu+~ArN2+<ArCHOH+<NO+<CO2;(2)对离去需由外面亲核试剂协助的离去基团(SN2过程):Me+<Cl+<Br+<D+~RCO+<H+~I+<Me3Si+。这种顺序可以说明人们估计形成什么样的芳烃正离子,从而得到可能发生哪一个亲电取代的概念。但是潜在的离去基团也能影响原始亲电试剂直接进攻那个位置的速度。在被氢原子以外的基团取代了的位置上的亲电进攻的分速度因子叫做:“自身所在位置的分速度因子”(ipso partial rate factors)。
3 亲核取代反应
3.1 反应机理
芳香族亲核取代反应的机理主要有四种。其中研究较多的为单分子历程(SNAr1)、双分子历程(SNAr2)和苯炔历程。另外,单分子负离子基历程(SRN1)也曾见诸报导。
3.1.1 SNAr1历程
SNAr1历程在芳香族亲核取代反应中比较少见。事实上,只有最有效的离去基团,如重氮基团,才按这样的历程进行反应:
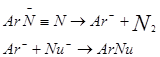
SNAr1历程可以通过以下事实证明:
(1)反应速度在重氮盐为一级,而和Nu-的浓度无关;
(2)加入高浓度的卤素负离子,则形成的产品为卤代芳香烃,但反应速度与加入的盐的浓度无关;
(3)由苯基重氮盐形成苯酚的速度,在水中和在重水中一样;
(4)芳香环上的吸电子取代基降低反应速度;而给电子取代基,在间位上提高反应速度,在对位上降低反应速度;
(5)使用邻位重氢化的作用物进行反应时,同位素效应约为1.22;
(6)利用标记的亚硝酸和苯胺或甲苯胺作用时形成的重氮盐,可以证明反应的第一步是可逆的键断裂;
(7)在重氮盐的分解作用里形成的碳正离子也可通过氢转移反应得到证明。
3.1.2 SNAr2历程
大部分发生在芳香环上的亲核取代反应都按SNAr2历程进行。该历程包括两步:
第一步:
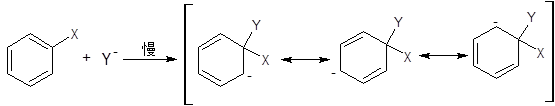
第二步:
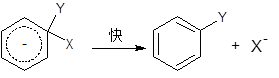
第一步通常是决定速率的,但也是不一定。
支持该历程的证据很多,如:反应动力学、取代基、介质效应,尤其是反应中间体的离析和鉴定。现简要介绍如下:
(1)动力学 研究结果表明该反应为二级反应;
(2)取代基效应 从有关实验资料可知,芳香环上的取代基对反应速度的影响是明显的;
(3)离去基团 离去基团对反应的影响也表明反应是按SNAr2历程进行的;
(4)溶剂效应 同样证明了反应按SNAr2历程进行;
(5)碱的催化作用 同样证明了反应按SNAr2历程进行;
(6)中间体的离析 芳香族亲核取代反应的中间体时常具有相当的稳定性,可以从反应混合物中离析出来。此类复合物的形成,以及它们的稳定性和它们转变为双负离子的可能性,都为SNAr2历程提供了结论性的证据。
3.1.3 苯炔历程
某些芳香族亲核取代反应的特点显然是和按SNAr1历程和SNAr2历程进行的反应不一样。这些反应发生在没有活化基团的芳香卤化物上,需要比较强的碱来催化,而且进入基团不是永远的取代阿离去基团所在的位置上。例如,1-14C氯苯和氨化钾作用形成两种不同的产品:
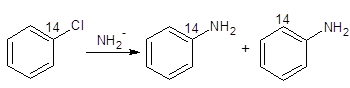
这里形成的两种产品的量几乎是相等的。
这种反应是通过消除-加成历程进行的。下面是支持这一机理的一些证据:
(1)若芳基卤包括两个邻位取代基,这个反应就不能发生;
(2)变位(cine)取代;
(3)卤化物的反应性顺序是:Br>I>Cl>>F(反应在液NH3中与KNH2进行时)的事实,说明SNAr机理在此处是不起作用的。




